醫事檢驗科檢驗手冊 文件編號: LAB-QP-004 版次:6 發行日期:2021/09/30
二、檢體採取原則
二、檢體採取原則
1. 一般原則1.1 採檢前務必切實核對病人身分
a) 請病人自行說出姓名及出生年月日核對。
b) 若病人無法自行說出姓名及出生年月日時,請負責照護人員、家人確認,或運用健保卡、身分證等相關證件、手(腳)圈上的姓名及出生年月日或病歷號資料進行核對。
1.2 檢體需依照規定方式採取,並放置於指定容器內,並依規定添加添加劑(例如:防腐劑)。b) 若病人無法自行說出姓名及出生年月日時,請負責照護人員、家人確認,或運用健保卡、身分證等相關證件、手(腳)圈上的姓名及出生年月日或病歷號資料進行核對。
1.3 採檢前需留意採檢用具及採檢容器是否過期。
1.4 檢體量須達最低採檢量。
1.5 檢體採集完畢,容器上務必加註病人基本資料;必要時需在檢體上加註採檢者姓名。
1.6 檢體採集完畢,需依照規定時間及傳送方式傳送至檢驗單位。
1.7 檢體如以特殊方式採取時,須在檢驗單上註明採檢方式或檢體種類。
(例如:以導尿方式取得之鏡檢常規尿液檢查檢體、以靜脈血液進行血液氣體分析檢查等)
1.8 採集檢體時所使用之採檢用具如:導管、針筒、手套等,使用後需視為生物醫療感染性廢棄物處理;廢棄之針頭、刀片等尖銳物品或器械,須直接丟入標有感染標誌之塑膠或不鏽鋼容器內,且容器應使用不被穿透、不回彈及無法在開啟的容器。
1.9 不小心被針頭(尖銳物品)扎到時,應立即報告勞安室,填寫尖銳物品扎傷表單,掛感染管制科看醫生,三個月內抽血追蹤檢查。
1.10 隱私維護:
為確保病患檢體隱私性及安全性,檢體採集後的存放場所或容器及採檢人員須依循下列規範:
a) 不可公開談論與病患檢體相關之事宜。
b) 應避免他人能觀看到檢體上的標示而洩漏出病人資訊。
c) 應避免檢體被調包、竊取或破壞的情形。
b) 應避免他人能觀看到檢體上的標示而洩漏出病人資訊。
c) 應避免檢體被調包、竊取或破壞的情形。
2. 血液檢體採取原則
2.1 採血管種類及真空採血順序
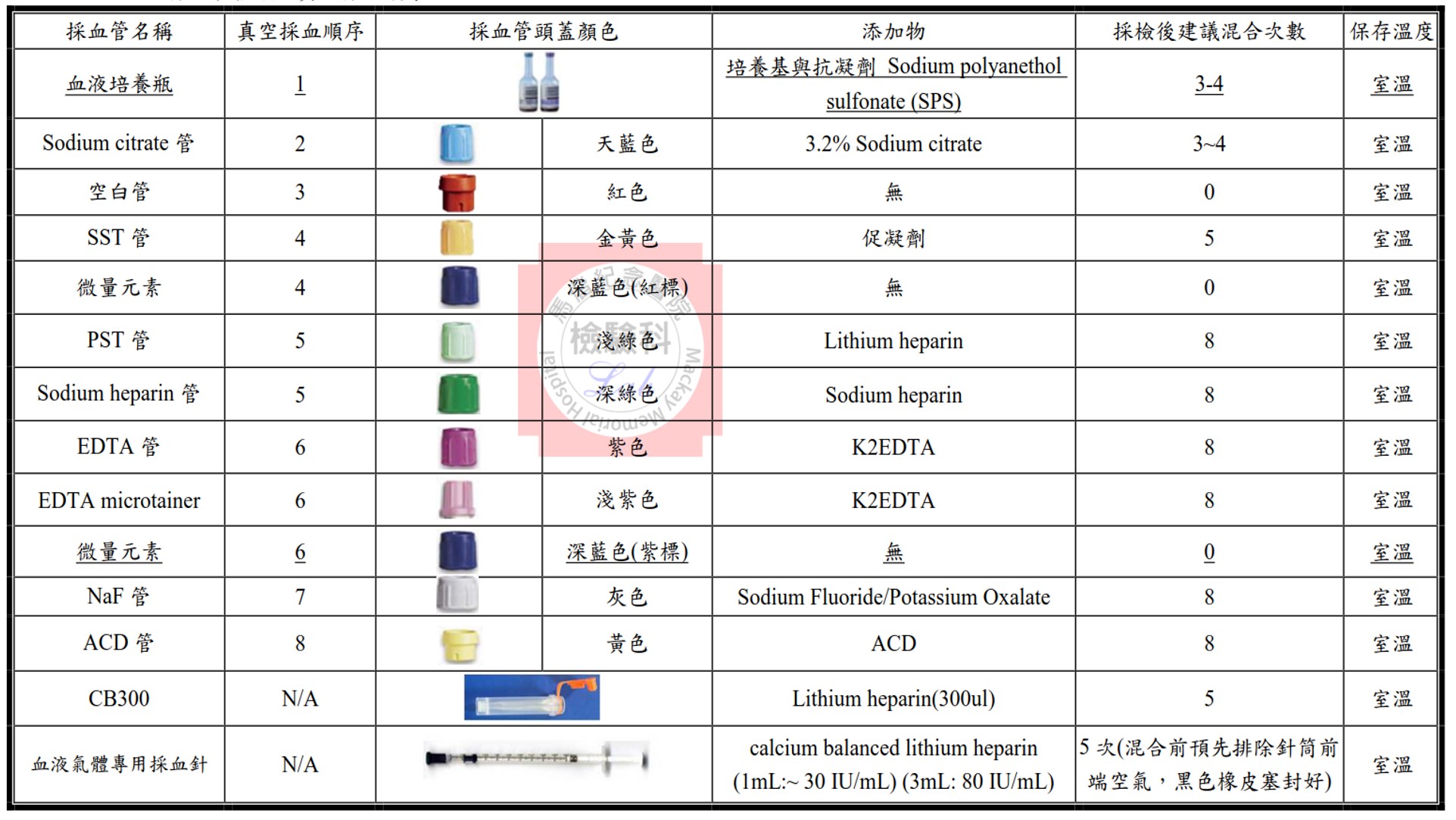
2.2 一般採血原則
a) 採血前須先準備適當的採血管及採檢用具。
b) 盡量以21、22、23號的針頭採血,以避免溶血現象。
c) 採血時需注意採血管順序,以避免採血管內添加物交互污染,影響檢驗結果;若需同時採集血液培養檢體時,則須先採集血液培養用檢體後再依序採集其他檢檢驗項目之檢體。
d) 盡量以真空採血方式採血;若遇到較細血管,不適合直接使用真空採血方式時,可改用蝴蝶針配合採血轉接器採血。
e) 以注射針筒採血時,採血後須先把針頭拿掉,再沿管壁輕輕的將血液注入試管中。
f) 避免將不同採血管內檢體相互混合,或是將檢體自採血管倒入另一種採血管中。
g) 採血前的鬱血時間(綁止血帶時間)不得超過2分鐘,以避免血液成份的變化。
h) 採檢時需依據檢測項目選擇採血管,採檢量以達到規定之檢體量為原則,否則須達最低血量。
i) 採檢前需切實確認病人身分,且病人必須依據其檢測之項目達到規定之空腹時間或是符合飯後兩小時血糖檢測的時間。
j) 依檢驗項目不同決定病患是否空腹8~12小時,若為速件需要或醫生要求時,可不用絕對空腹採檢。
k) 採檢前需確認病人是否有禁治療部位。避免於在注射點滴、藥物或輸血的四肢採檢。
l) 採檢完畢,需依採血管種類適當上下混合檢體;採檢者需立即貼上可辨識病人身分之標籤或以其他方式詳加註記,並且在檢體上簽章或以其他方式註記採檢者身分。
m) 血液檢體須依檢驗項目之需求與傳送條件加以傳送。
2.3 血液常規(CBC)採血原則
a) 一般血液常規檢查檢體,是使用內含抗凝劑K2EDTA的紫色頭蓋血液採血管。全血量為3~5 mL,最低量為2 mL。微量粉紅蓋血液採血管內含抗凝劑K2EDTA,提供給小兒或不易採集血液者使用,最低量為0.5 mL。
b) 血液組使用血液自動分析儀上機,檢體自動上機量為3-5 mL,檢體不足1 mL需開蓋上機,開蓋上機最低量為0.5 mL。
c) Cryoglobulin採血後放入生化真空(無gel)試管,需空腹8小時,以避免離心後脂血影響判讀。
d) Fragility Test(No incubation)、Fragility Test(Overnight incubation)採血後放入含Heparin綠頭蓋真空採血管。Fragility Test(Overnight incubation)需無菌操作,此項檢查時血液組需要做檢驗前準備,作此檢驗需與血液組約時間。
e) Malaria最好在病患發熱情況下採血。
f) Filaria的最佳採血時間是9PM~4AM。
g) 血液及骨髓特殊染色的抹片檢體都不可含抗凝劑。
h) ESR及Hb-EP項目受檢體量限制不可使用微量粉紅蓋血液採血管。其他一般血液常規檢查如果真的無法採集足量檢體,交由後線組別聯絡醫師就現有的血量進行可以做的檢驗項目。
2.4 血液凝固採血原則
a) 檢體是抗凝劑為3.2% sodium citrate與全血比例為1:9(0.3mL 抗凝劑+2.7mL全血)或(0.2 mL 抗凝劑+1.8mL全血)的藍色頭真空試管,其比例1:9的目的在於完全中和血漿中的鈣離子。
b) 止血帶使用時勿過久或太緊,不然容易造成淤血而導致 Factor Ⅷ上升。
c) 因不良的穿刺所造成的組織外傷(trauma),會引起組織液污染而加速凝固因子的活化,使凝固因子分析的結果假性縮短。故在抽血時最好將前段血液3~5mL丟棄或供他種檢驗,而取後段血液作凝固因子分析。
d) 採血後應上下小心輕輕混合數次,避免溶血而使細胞膜的磷脂質活化凝血。
2.5 新生兒/小兒採血原則
a) 新生兒及小兒只須少量血液檢體(少於1mL)時,可利用皮膚穿刺方式採血。
(一歲以下幼兒盡量避免指尖採血)
b) 採檢的部位限以中指或無名指指尖及足跟兩側為主;不可穿足跟中央部位,以避免骨膜發炎。
c) 由穿刺部位滲出的第一滴血通常混有組織液,需拭掉第一滴血後才收集檢體,以避免干擾檢驗結果。
d) 禁止以用力擠壓方式採血,避免組織液大量滲入檢體及造成溶血。
e) 皮膚穿刺採血時,須先熱敷或按摩採血部位後再進行穿刺。
2.6 血液氣體檢驗項目採血原則
a) 使用GAS專用採血針,新生兒可使用CB300含Lithium Heparin 。
b) 採血完畢混合檢體前,須先排除針筒前端空氣,並以parafile封好,以免氣泡干擾檢驗結果。
c) 採檢後須立即傳送至檢驗科檢驗。
2.7 血清/免疫檢驗項目採血原則
a) CH50檢驗項目檢體,採檢後需立即以冰浴方式傳送至檢驗科處理,以避免力價降低。
b) Homocysteine採檢前病人需空腹8-12小時,採檢後需立即以冰浴方式傳送至檢驗科處理。(若夜班或假日送檢時,需將檢體離心後取血漿保存於-20℃)。
c) Homocysteine、SCC、NSE、Insulin不接受溶血檢體,Anti-SSA、SSB,Anti-SM、RNP,Anti-dDNA,Anti-CCP, Ribosomal P Ab,若遇溶血或脂血檢體需加以註記。
d) ACTH、PRA、I-PTH、Aldosterone、IGF-1、25-OH Vitamin D、分生血液項目(定量PCR血液類檢體)、17-α-OH progesterone採檢後需立即以冰浴方式傳送至檢驗科處理。(若夜班或假日送檢時,需將檢體離心後取血漿保存於-20℃)。
2.8 備血檢體採血原則
a) 住院病患、門急診病患與入院新病患之備血檢體採血原則依一般備血、速件備血或緊急備血流程處理。
b) 採檢後需給病人戴上手圈(只有門診病患),備血檢體須貼上有病人基本資料之標籤,及採血者簽章,以示確認。
2.9 新生兒篩檢/代謝性罕見疾病篩檢採檢專用濾紙片採血原則
a) 新生兒篩檢採血以皮膚穿刺採血方式為主。可以用CB-300(含Lithium Heparin,70-75μL)收集定量的血液檢體,並將血液均勻塗抹於濾紙圈內。
b) 較大兒童如使用注射針筒採檢時,注射針筒需卸除針頭後再滴一滴於濾紙圈內。
c) 製作血片時,須於濾紙片正面滴一滴血液,並讓血液自然擴散填滿圓圈;嚴禁重複滴入血液或正反面塗抹,以避免濾紙吸附血量不均,導致檢體不足。
d) 先天性代謝性新生兒篩檢需塗滿5個圓圈。
e) 血液尚未完全陰乾以前,不可將濾紙重疊存放,以避免檢體間交互污染。
f) 未使用之濾紙片須妥善保存,以避免因污染干擾檢驗結果。
先天性代謝性新生兒篩檢
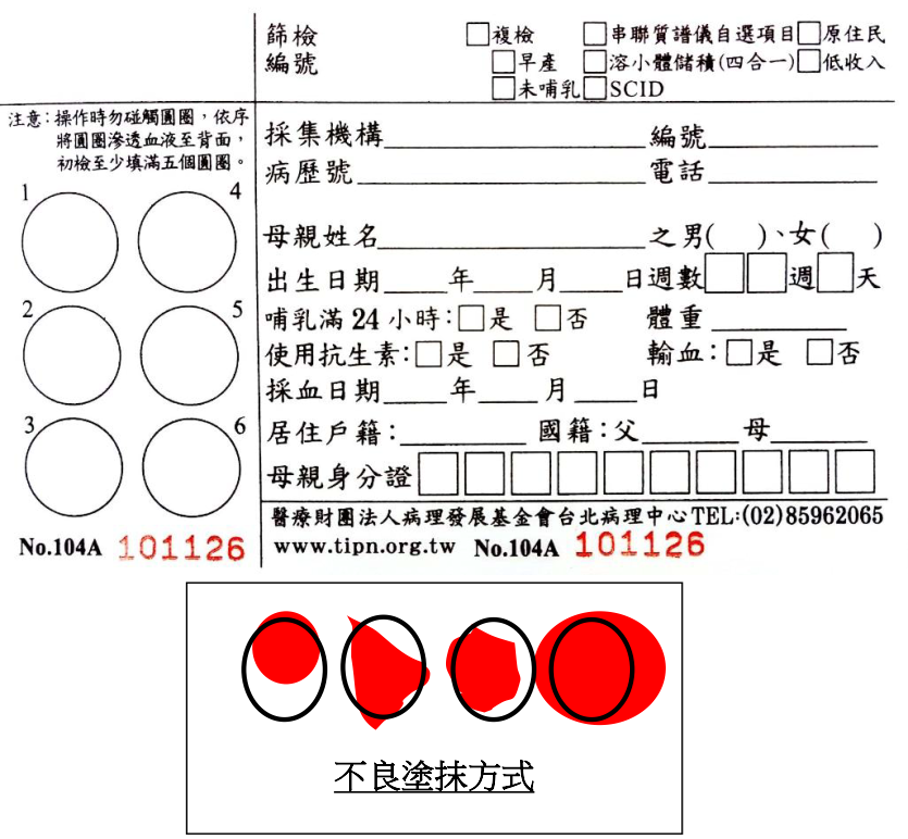
3. 驗科人員採血服務時段
3.1 門診採血服務:速件與非速件受檢患者採血時段為星期一~星期六的早上7:00~夜診結束,由受檢者後親自到門診檢驗室接受採血檢驗。
3.2 急診採血服務:護送人員將患者帶至急診檢驗室採血。但若緊急狀況時會由急診室電話通知急診檢驗醫檢師前往急診室採血,或由急診護理人員抽完後送至急診檢驗室。
3.3 檢驗科人員至病房採血服務時段:
| 採血時段 | 單位 | 服務項目 | 收單截止時間 |
| 07:00 | 所有病房: | 星期一~星期六:所有項目(包含備血) | 05:00之前(3:00後若有改單請電話通知檢驗科) |
| 國定例假日:速件(包含備血) (血清項目不單抽,委外項目不抽) | |||
| 10:00 | 六樓兒科: | 速件與CBC Routine | 09:30之前 |
| 其他病房: | 速件與PC (包含備血) | ||
| 14:00 | 六樓兒科: | 速件與CBC Routine | 13:30之前 |
| DR: | CBC Routin (284+208),RPR | ||
| BR: | 速件電解質,Bilirubin | ||
| 其他病房: | 速件與PC (包含備血) | ||
| 19:00 | 所有病房: | 速件(包含備血) (血清項目不單抽,委外項目不抽) | 18:30之前 |
| 22:00 | 所有病房: | 速件(血清項目不單抽,委外項目不抽) | 21:30之前 |
| 注意 事項 |
|
||
| 不列入 採檢的 作業範圍 |
|
||
4. 尿液檢體採取原則
4.1 鏡檢常規尿液檢查
a) 病人如自行採檢,採檢前須先洗淨雙手及拭清外陰部後再採檢。
b) 檢體不需加入任何添加物及保存劑。
c) 常規尿液檢查檢體以早上第一次晨尿為原則,任一單次尿液檢體亦可;女性病人收集尿液檢體時應盡量避免陰道分泌物或生理期血液之污染;必要時可以用導尿的方式取得檢體。
d) 尿液檢體必須於採檢後盡速送至檢驗單位;如無法於兩小時內送達時,需以冰浴方式送檢;若無法於採檢當日送達時,則必須將檢體置於冰箱冷藏保存(約2-8℃)後隔日送檢。
e) 健康檢查之尿液檢體須於健檢中心現場採集,並盡速進行處理。
f) 常規尿液檢查檢體需11-12mL(至少3mL),若是檢測B-J protein、Paraquet、Urine myoglobin等項目則需10-20mL以上。
4.2 中段尿檢體採取方式:
a) 先洗淨雙手。
b) 解前段尿丟棄。
c) 留中段尿液於指定容器內以供檢驗。
d) 剩餘的尿液丟棄。
e) 檢體量與檢體運送及保存條件,需依檢驗項目參閱相關組別作業規則說明。
4.3 24小時尿液檢體留取方式:
a) 收集時間:當日8:00-隔天8:00。
b) 第一天早上8:00尿液先排掉不保留,其後的尿液均需保留在特定容器內,置於冰箱冷藏保存,持續收集到隔天早上8:00為止。
c) 收集完成後需將總尿量記錄於檢驗單上,配合醫令項目取適量的尿液檢體置於特定容器內,於兩小時內送至檢驗單位;如無法於兩小時內送達時,需以冰浴方式送檢送至檢驗科檢驗。
d) 24小時尿液檢體需依檢驗項目不同需添加特定防腐劑(請依檢驗項目參閱相關組別作業規則說明);使用防腐劑時應充分混合,以避免尿液成分改變。
e) 如果24小時尿液檢體收集過程中不須添加任何防腐劑時,請務必收集後立即將檢體置於冰箱冷藏保存,以避免細菌孳生,干擾檢驗結果。
4.4 生化、血清尿液檢查檢體留取方式:
a) 單次尿液檢體比照鏡檢常規尿液檢查規定留取檢體。
b) 檢體量、添加物種類及檢體運送及保存條件,需依檢驗項目參閱相關組別作業規則說明。
4.5 特殊尿液檢體留取方式:
a) 生理期婦女:可以用導尿的方式取得檢體,以避免干擾檢驗結果。
b) 留置導尿管病人:需由導尿管直接抽取尿液檢體,避免由尿袋倒取檢體,以免取到污染檢體,干擾檢驗結果。
c) 嬰幼兒:可以利用嬰幼兒專用尿袋收集尿液檢體。
d) 檢體量、添加物種類及檢體運送及保存條件,需依檢驗項目參閱相關組別作業規則說明。
e) 以導尿、穿刺或其他特殊方式留取尿液檢體時,需於檢驗單上註明採檢方式。
5. 糞便檢體採取原則
5.1 容器為無菌集尿杯或S-Y feces test bottle,且毋須任何添加物。
5.2 糞便細菌培養檢體採取原則請參照細菌培養檢體採取原則說明。
5.3 採檢時需用乾淨竹棒或S-Y feces test bottle內含之採檢棒挖取適當量之檢體,採檢時請避免挖取沾到馬桶內尿液及自來水的部分。
5.4 檢體禁止置於衛生紙或擦手紙上,亦不可用棉花棒挖取。
5.5 若需以化學法檢測糞便潛血時,病人需於採集前連續2~3天禁食紅肉、肝臟及含peroxidase的蔬果(例如:菠菜、甘藍、花椰菜等),以避免造成偽陽性結果,禁止食用維他命C,避免產生偽陰性。(免疫法不在此限)。
5.6 檢體需於採集後二小時內送達檢驗單位,若無法當日送達時,必須將檢體置於冰箱冷藏保存(約2-8℃)後隔日送檢。
5.7 寄生虫卵或阿米巴原蟲檢查項目之檢體須採集後二小時內立即送達檢驗單位,送檢過程中請勿冷藏。
5.8 檢體量
a) 單項糞便潛血檢查(限化學法):花生米粒的大小,避免過多或過少。
b) 單項寄生虫卵或阿米巴原蟲檢查:最好達無菌集尿杯刻度「15」處。
c) 其他常規糞便檢驗項目:至少達無菌集尿杯刻度「15」處。
d) α1-Antitrypsin檢驗項目;至少達無菌集尿杯刻度「30」處。
e) Rotavirus檢驗項目:少量即可。
b) 單項寄生虫卵或阿米巴原蟲檢查:最好達無菌集尿杯刻度「15」處。
c) 其他常規糞便檢驗項目:至少達無菌集尿杯刻度「15」處。
d) α1-Antitrypsin檢驗項目;至少達無菌集尿杯刻度「30」處。
e) Rotavirus檢驗項目:少量即可。
6. 體液檢體採取原則
6.1 脊髓液的採取原則上分三支試管採取,第一支供生化定量,第二支供細菌培養,第三支供細胞一般檢驗。
6.2 採檢時,應避免手套的滑石粉混入。
6.3 胸水、腹水、關節液等檢體若要進行細胞計算檢查時,每10mL的檢體需另加0.1mL Heparin或EDTA等抗凝劑,以避免檢體凝固。
6.4 腦脊髓液的檢體不可含抗凝劑。
7. 精液檢體採取原則
7.1 精液常規檢查檢體採集前病人必須禁慾3至5天;採集時以手淫法取得檢體,並直接置於指定容器內。
7.2 勿使用保險套收集檢體。
7.3 精液檢體需於採檢後30分鐘內送至檢驗單位,並於檢驗單上註明採檢時間。
8. Influ A+B Ag快速檢查檢體採取原則
8.1 採檢時用無菌專用棉棒插入鼻孔中直到接觸到鼻甲(距鼻孔約2.54公分的距離),轉動棉棒數圈,並將棉棒置入乾淨試管中。
8.2 採檢後需立即送至檢驗單位檢測。
8.3 此項檢查亦適用於下列檢體:鼻腔拭子、鼻咽拭子、鼻咽抽出液、鼻咽沖洗液
9. 細菌培養檢體採取原則
9.1 一般檢體收件之原則:
a) 檢驗單的開立,需項目清楚,註明病患完整資料(包括日期、患者姓名、年齡、性別、病歷 號碼、病床號或門診別。)、特殊註明資料(如是否服用抗生素治療或採集部位等)、採檢日期及採檢人員簽名。
b) 請再次確認檢體與患者基本資料及檢驗項目是否完整無誤(以避免延遲病人報告及再次採取檢體時間)。
c) 當收到未完整標示的檢體,檢驗單之基本資料與檢體標示不相符,或是由採檢單位主動通知檢體標示錯誤之檢體,當採檢單位可確認該檢體為此病人的,請採檢單位執行檢體標示,並簽名,無法當場確認則一律重新採檢送驗,以確保檢驗結果的正確性。
d) 若檢體無法符合檢測要求,但臨床上有需求,與臨床單位溝通後確認以此檢體進行檢驗時,須在檢驗報告上加註檢體狀況及醫師代碼。
e) 口頭申請檢驗單內項目變更,先確定檢體是否達到受理條件,再請申請單位補送檢驗單。
f) 採檢適當的檢體量,因為當檢體量不足時會造成偽陰性。
g) 選擇正確的部位採檢,使用適合的技術收集檢體。
h) 使用適當的收集容器,確保活性,減少細菌增生。
i) 避免污染,確實消毒檢體應避免正常菌叢(例如皮膚、黏膜、呼吸道)污染,並確定檢體採自感染源,因為正常菌過度生長會干擾結果影響臨床判讀。
j) 接受抗生素治療的病人,在抗生素濃度最低時,最適當收集檢體。
b) 請再次確認檢體與患者基本資料及檢驗項目是否完整無誤(以避免延遲病人報告及再次採取檢體時間)。
c) 當收到未完整標示的檢體,檢驗單之基本資料與檢體標示不相符,或是由採檢單位主動通知檢體標示錯誤之檢體,當採檢單位可確認該檢體為此病人的,請採檢單位執行檢體標示,並簽名,無法當場確認則一律重新採檢送驗,以確保檢驗結果的正確性。
d) 若檢體無法符合檢測要求,但臨床上有需求,與臨床單位溝通後確認以此檢體進行檢驗時,須在檢驗報告上加註檢體狀況及醫師代碼。
e) 口頭申請檢驗單內項目變更,先確定檢體是否達到受理條件,再請申請單位補送檢驗單。
f) 採檢適當的檢體量,因為當檢體量不足時會造成偽陰性。
g) 選擇正確的部位採檢,使用適合的技術收集檢體。
h) 使用適當的收集容器,確保活性,減少細菌增生。
i) 避免污染,確實消毒檢體應避免正常菌叢(例如皮膚、黏膜、呼吸道)污染,並確定檢體採自感染源,因為正常菌過度生長會干擾結果影響臨床判讀。
j) 接受抗生素治療的病人,在抗生素濃度最低時,最適當收集檢體。
k) 陰道-B型鏈球菌篩選細菌培養鑑定檢查
(1) 使用細菌培養用採檢拭子。
(2) 請孕婦平躺雙腳弓起,將採檢拭子置放入孕婦陰道口內約2公分處,採集黏膜分泌物(勿使用窺陰器)。
(3) 使用同一採檢拭子,置放入孕婦肛門口內約2.5公分處,以旋轉方式採集檢體。
(4) 將採檢拭子放回採集容器中。
(5) 儘速送檢。
(6) 若無法馬上送檢,可於4oC下可保存24小時。
(7) 檢驗單上務必要註明孕婦採檢之週數(35~37週)。
(2) 請孕婦平躺雙腳弓起,將採檢拭子置放入孕婦陰道口內約2公分處,採集黏膜分泌物(勿使用窺陰器)。
(3) 使用同一採檢拭子,置放入孕婦肛門口內約2.5公分處,以旋轉方式採集檢體。
(4) 將採檢拭子放回採集容器中。
(5) 儘速送檢。
(6) 若無法馬上送檢,可於4oC下可保存24小時。
(7) 檢驗單上務必要註明孕婦採檢之週數(35~37週)。
9.2 各式採檢容器

9.4 細菌培養檢體收集、傳送、保存的操作指引
| 檢體種類 | 採集方法 | 容器最低檢體量 | 傳送 溫度/時間 |
保存 溫度/時間 |
運用限制 | 注意事項 | |
| Abscess | 1.用無菌水或75%酒精清潔表面。 2.用針和空針抽取感染物質。 3.或以無菌空針打入無菌水再回抽檢體。 4.若所獲得的檢體不足時,再重複做一次。 |
棉枝輸送管 無菌塑膠管 無菌玻璃管 |
≦2h/RT | ≦2h/RT | 1天 | 1.棉枝檢體要求做Gram stain,需傳送兩支棉枝, 一支做培養一支做染色。 2.棉枝檢體要求做TB培養染色最好傳送>2支。 3.標示檢體種類尤其腦、肺、肝等的Abscess檢體。 |
|
| Blood | 1.75%酒精去除表面的污痕或油脂,然後待其完全乾。 2.用棉枝沾優碘由中心點劃圓圈,從中心點向外移,讓優碘乾(約2分鐘)。 3.再用75%酒精擦掉優碘,待其完全乾。 4.75%酒精擦拭血瓶瓶口完全乾,通常需要30-60秒。 5.先打到厭氧瓶再打到需氧瓶。 6.搖動血瓶,避免凝固。 |
血瓶種類: 成人血瓶≥ 20mL/套 小孩血瓶 ≥ 1mL/瓶 TB/Fungi culture請使用MYCO/F-Lytic血瓶(紅色) |
≦2h/RT | ≦2h/RT | 1天 | 1.急性高燒必需馬上抗生素治療,治療前從不同部位連續抽兩套。(若要從同部位採檢須間隔至少30分鐘) 2.不明原因發燒、亞急性心內膜炎或持續性菌血症或黴菌血症,最多不超過三套。 3.接受抗生素治療的病人做血液培養,最適當的時候在抗生素濃度最低時。 4.不容易抽時,血液從catheter的部位抽血,則第二套血液培養必須自周邊的血液抽。 |
|
| Bone Marrow | 以外科手術方式收集檢體 | 血瓶 (TB/Fungi culture請使用MYCO/F-Lytic血瓶) 無菌塑膠管 無菌玻璃管 |
≦24h/RT | ≦24h/RT | 1天 | 1.檢體量少可使用無菌玻璃管傳送。 2.由於收集過程複雜,所以比較可能造成污染。 3.主要培養特殊的致病菌,像是Brucella、Salmonella、Listeria、fungi和mycobacteria。 |
|
| Body fluid種類: Ascites Joint fluid Pleural effusion Bile CAPD Pericardial 心包膜液 |
1.用酒精或優碘消毒穿刺的部位預防檢體污染或病人感染。 2.以針筒往皮下抽取肋膜,心包膜,腹膜,或關節液。 3.當申請使用血瓶採檢,分裝需氧或厭氧血瓶,留一些(0.5mL)做Gram’s stain。 4.或全部放入無菌容器,避免使用抗凝劑。 |
血瓶≥20mL/套 無菌塑膠(玻璃)管>1mL TB culture請使用火箭筒離心管 |
馬上送 實驗室 |
≦24h/RT | 1天 | 不可使用抗凝劑,有些菌種會被這些抗凝劑抑制。 | |
| Drain fluid | 1.同Body fluid。 2.直接影像導引抽吸法 (Direct image-guided aspiration) |
棉枝輸送管 無菌塑膠管 無菌玻璃管 |
<2h/RT | ≦24h/RT | 1天 | 1.放置超過2天的引流液會產生不正確的培養結果,可能會誤導治療。 2.不接受引流管。 |
|
| 檢體種類 | 採集方法 | 容器最低檢體量 | 傳送 溫度/時間 |
保存 溫度/時間 |
運用限制 | 注意事項 | |
| CSF | 1.以iodine消毒穿刺的部位。 2.穿刺針插進L3-L4,L4-L5,L5-S1部位。 3.傳送第二支檢體做細菌檢查。 4.收集CSF依序分別放入3支無菌玻璃管,每支約1~2mL的CSF。 |
無菌塑膠(玻璃)管≥ 1mL | 不可冷藏 馬上送 實驗室 |
<2h/RT | NONE | ||
| Dental | 1.仔細清潔齒齦邊緣及表面,移除口水、殘渣。 2.小心刮取齒齦下的損傷物質。 3.放入棉枝輸送管。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | 只做厭氧培養。 | |
| Endocervix | 1.操作擴張器時不可使用潤滑劑。 2.使用棉枝先移除黏液及分泌物,將棉枝丟棄。 3.取一枝新棉枝深入子宮頸內採檢體。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | 檢體不可以冷藏 | |
| Genital ( male ) | 1.棉枝穿入尿道2-4 cm,旋轉棉枝2-3次。 2. for Gono:棉枝沾取分泌物。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | 檢體不可以冷藏 | |
| Vaginal | 1.先擦去舊的分泌物。 2.使用新的棉枝取最接近Vaginal黏膜的分泌物。 3.如果要做抹片需取第二支棉枝。 4.若培養GBS,不可使用擴張器採檢。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | 檢體不可以冷藏 | |
| Tissue | 收集主要損害部位組織或邊緣,避免取到壞死的老組織。 | 無菌塑膠管 無菌玻璃管 |
馬上送 實驗室 |
≦24h/RT | NONE | 1.只有組織穿刺無法獲得檢體時,才接受棉枝的檢體。 2.棉枝的檢體只有在傷口有感染跡象或慢性無法痊癒才接受。 |
|
| Gastric lavegef | 1.於早上未進食前或未離床前採檢。 2.使用鼻胃管進入胃中抽取胃液。 3.或打入無菌水25~50mL,再回抽檢體到無菌容器。 |
火箭筒離心管 TB culture請使用GJ-TB專用火箭筒離心管 |
馬上送 實驗室 |
≦24h/4℃(TB須室溫) | 1天 | ||
| 檢體種類 | 採集方法 | 容器最低檢體量 | 傳送 溫度/時間 |
保存 溫度/時間 |
運用限制 | 注意事項 | |
| Nasal | 1.給病人鼻內抗充血劑及局部麻醉劑。 2.確認中鼻道鄰近上頷竇一側抽吸。 3.以小棉棒從中鼻道收集引流液 |
棉枝輸送管 | <2h/RT | ≦24h,RT | 1天 | ||
| Oral | 1.使用棉枝移除傷口表皮分泌物及殘骸,棉枝丟掉。 2.另一棉枝沾取傷口,避免接觸正常組織。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | ||
| Throat | 1.用壓舌板於舌頭上。 2.使用一枝棉枝塗抹於扁桃腺及懸壅垂之後,避開舌頭、口腔黏膜和懸壅垂。 3.轉動棉枝前後來回沾取後面的咽喉(Pharynx)、扁桃區域和任何發炎或分泌區域。 |
棉枝輸送管 | <2h/RT | ≦24h/RT | 1天 | ||
| Ear | 1.將無菌棉枝插入耳道直到遇到阻力。 2.轉動棉棒收集液體。 |
棉枝輸送管 | <2h/RT | ≦24h/中耳室溫、外耳4℃ | 1天 | ||
| 自咳痰 (Sputum) |
1.收集檢體之前,病人要用無菌的生理食鹽水刷洗口腔或漱口。 2.不要咳出口水或鼻後的分泌物到容器內。 3.要深部咳出。 |
無菌塑膠瓶>1mL TB culture請使用火箭筒離心管 |
<2h/RT | ≦24h/4℃ | 1天 | 1.不接受收集24小時痰。 2.不可用衛生紙收集痰。 3.盡量收集早上晨第一口痰。 4.檢體運送延遲2小時以上沒冷藏,可能影響培養結果。 5.除非臨床有肺炎的存在(如發燒、發炎),氣管造口術才可用來做培養。 |
|
| 氣管內抽吸痰(Sputum) | 抽到的檢體放到無菌容器。 | ||||||
| 氣管造口術(Sputum) | |||||||
| Bronchoalveolar lavage (B.A.L) | 1.支氣管鏡進入呼吸道的內腔,灌入大量無菌水,(大於140C.C),檢體回抽含有遠端細支氣管和肺泡的分泌物。 2.最初收集的液體容易被污染需丟棄。 |
無菌塑膠管 無菌玻璃管 無菌塑膠瓶 |
<2h/RT | ≦24h/4℃ | 1天 | 延遲傳送超過1~2小時可能造成挑剔菌的流失,像S.pneumoniae及口鼻微生物叢過度生長。 | |
| Protected specimen brushings (PSB) |
1.經由支氣管鏡管道插入telescoping double catheter以polyethylene glycol塞住末端從呼吸道管壁。 2.放進一個小刷子,收集細胞間質。 3.小刷子放在1mL的無菌水裡。 |
無菌塑膠管 無菌玻璃管 |
<2h/RT | ≦24h/4℃ | 1天 | 1.PSB適合做厭氧培養。 2.延遲傳送超過1~2小時可能造成挑剔菌的流失,像S.pneumoniae及口鼻微生物菌叢過度生長。 |
|
| 檢體種類 | 採集方法 | 容器最低檢體量 | 傳送 溫度/時間 |
保存 溫度/時間 |
運用限制 | 注意事項 | |
| Eye | 1.兩眼分別採檢,使用無菌水潤濕的棉枝在結膜或角膜滾動數次。 2.馬上接種於培養基上。 3.或放入棉枝輸送管。 4.若要做抹片,需另取檢體直接塗於抹片上1×2公分的範圍。 |
平板培養基 棉枝輸送管 |
培養皿 馬上送 實驗室 棉枝 <2h/RT |
≦24h/RT | 1天 | ||
| 開放性傷口 | 1.用無菌生理鹽水徹底清洗傷口表面的區域,移走表面分泌物。 2.用解剖刀、棉棒、消毒紗布移走覆蓋於傷口的一些殘骸。 3.從損害的主要部位收集小組織或從邊緣刮取檢體。 4.當傷口相當乾,則使用兩支沾濕無菌水的棉枝採集檢體。 5.棉枝輕輕在傷口表面滾動大約五次,且集中於有化膿或有發炎組織跡象的位置。 |
棉枝輸送管 無菌塑膠管 無菌玻璃管 |
≦2h,RT | ≦24h,RT | 1天 | 1 棉枝檢體要求做Gram stain,則須傳送兩枝棉枝,一支做培養一支做染色。 2棉枝檢體要求做TB培養染色最好傳送>2支。 3不能培養≦12h動物咬傷傷口。 4標示檢體種,尤其腦、肺、肝等侵襲方式取得檢體。 5 標示解剖位置(臂、腿或左、右 等)。 6不接受用含有formalin的檢體。 |
|
| 膿 | 1.用注射器和針頭抽取損害最深的部位的分泌物。 2.從損害的主要位置收集小組織或邊緣刮取檢體。 |
棉枝輸送管 無菌塑膠管 無菌玻璃管 |
≦2h,RT | ≦24h,RT | 1天 | ||
| Semen | 1.用肥皂清潔生殖器並擦拭乾淨。 2.將精液留於無菌塑膠瓶。 |
無菌塑膠瓶 | <2h/RT | ≦24h/RT | 1天 | 檢體不可以冷藏 | |
| Tip ( I.V Catheter Tip ) |
1.在catheter移除前皮膚用75﹪酒精清潔。 2.拿著catheter露在外面那端,使用無菌的工具小心從病人身上移除,避免接觸皮膚。 3.拿著遠端放入無菌管內,以無菌剪刀剪tip約5公分放入無菌玻璃管內。 |
無菌塑膠管 無菌玻璃管 |
<2h/RT | ≦2h/4℃ | 1天 | 1.不接受導尿之catheter tip。 2.不接受catheter tip放在食鹽水或運送培養基中。 3.不接受從catheter部位採集的棉枝。假如有局部感染的症狀,傷口穿刺是較好的。 4.移除catheter前採集兩套血液培養,一套經catheter另一套經週邊部位,同時與catheter tip作培養。 |
|
| 檢體種類 | 採集方法 | 容器最低檢體量 | 傳送 溫度/時間 |
保存 溫度/時間 |
運用限制 | 注意事項 | |
| Stool | 1.病人應將大便放進一個乾淨、乾燥的容器。 2.傳送至少5mL的腹瀉大便,1g的大便或豆子大小的大便檢體裝於棉枝輸送管。 |
棉枝輸送管 無菌塑膠瓶 |
無菌塑膠瓶≦1h RT 棉枝輸送管≦24h/RT |
≦24h/4℃ | 1天 | 1.拒收超過3天住院病人,除非醫師要求,C.difficle culture例外。 2.不要傳送硬、固體stool。 3.拒收乾燥swab。 4.拒收stool 收集後沒放在棉枝輸送管>2 h。 5.不可用衛生紙收集檢體。 |
|
| 直腸拭子 | 1.無菌棉枝通過肛門括約肌約1 英吋。 2.小心地轉動棉枝,接著收回棉枝。 3.棉枝放入棉枝輸送管。 |
棉枝輸送管 | 棉枝輸送管≦24h/RT | ≦24h/4℃ | 1天 | ||
| C.difficle culture 及 C.difficle GDH and toxin |
收集有黏液或液體,不成形的糞便。 | 無菌塑膠瓶>5mL | ≦1h /RT | ≦24h/4℃ | NONE | 須新鮮糞便檢體送驗,不可加驗。 | |
| 中段尿 | 指導病人開始排尿就不要停止,丟掉前段尿,直接使用無菌容器收集尿液。 | 無菌塑膠瓶≥ 1mL 無菌玻璃管≥ 1mL TB culture請使用火箭筒離心管>40mL |
<2h/RT | ≦24h/4℃ | 1天 | 1.儘可能於收集早晨第一次尿。尿液在膀胱內隔夜或至少4小時可減少偽陰性。 2.不可強迫病人攝取液體。過量液體攝取會稀釋尿液及降低菌落數<105 CFU ⁄ mL。 3.女性必需避開月經期。 4.不要收集便盆或尿壺裡的尿液。 |
|
| 存留導管尿 | 於導管入口處用酒精棉球清潔後,使用空針收集尿液,不可取導尿袋的尿液。 | ||||||
| 單次導管尿 | 1.單導的過程必須無菌技術操作,避免將微生物導入膀胱的風險。 2.先丟棄最初15至30mL的尿液,再收集尿液作培養。 |
||||||
| 恥骨穿刺 | 1.穿刺前膀胱必需充滿尿液並摸得出來。 2.膀胱上方的皮膚需剃毛及消毒。 3.使用空針穿刺抽取尿液。 |
適合於排尿困難之嬰兒,及懷疑厭氧菌感染。 | |||||
10. 病毒檢體採取原則
10.1 病毒培養檢體
a) 咽喉標本(throat swab)
用無菌棉棒擦拭喉內扁桃腺及咽喉側部位,迅速將棉棒斷入採集瓶中,收集後瓶蓋旋緊。
b) 鼻腔,呼吸道標本(Nasal swab,Nasopharyngeal aspirate,Sputum)
Nasal swab用無菌棉棒擦拭鼻腔,迅速將棉棒斷入採集瓶中。Nasopharyngeal aspirate,Sputum,抽痰,迅速將管子斷入採集瓶中。收集後瓶蓋旋緊。
c) 眼液標本(Eye swab)
無菌棉棒先用生理食鹽水沾濕,再輕拭患部,迅速將棉棒斷入採集瓶中。收集後瓶蓋旋緊。
d) 直腸拭子(Rectal swab)
用無菌棉棒插入肛門5公分處,旋轉後取出,迅速將棉棒斷入採集瓶中。收集後瓶蓋旋緊。
e) 糞便標本(Stool)
收集新鮮糞便標本1-2gm放入無菌空瓶中送檢。
f) 尿液標本(尿液)
收集晨間第一次小便5-10ml,裝入無菌玻璃試管中。
g) 脊髓液標本(Cerebrospinal fluid)
用腰椎穿刺技術收集1-2mlCSF,裝入無菌玻璃試管,4℃運送。
h) 血液標本(Blood)
不常用來作病毒分離,如需用則抽血3-5ml裝有抗凝劑(EDTA)的無菌玻璃試管。
i) 皰液及患部刮取物(Vesicle fluid & Scraping)
先用75﹪酒精消毒患部表面,用26-27號針頭的針筒先抽0.1mL收集液,再抽疱液,然後注入收集瓶中。或者先刺破水皰,然後用棉棒沾取,再斷入採集瓶中。
j) 生殖道檢體
尿道檢體(男性)
患者最好在採取檢體前一小時未解尿,將棉棒伸入尿道2-4公分。旋轉棉棒並取出,斷入採集瓶中。
子宮頸檢體
將Exocervix以棉棒去除黏液,丟棄此棉棒。將另一支長棉棒伸入子宮頸之管道,直到整個棉花拭子看不到為止。旋轉棉棒5-10秒鐘,取出棉棒(勿接觸到陰道管壁),斷入採集瓶中。
10.2 病毒培養檢驗標本採檢及運送注意事項患者最好在採取檢體前一小時未解尿,將棉棒伸入尿道2-4公分。旋轉棉棒並取出,斷入採集瓶中。
子宮頸檢體
將Exocervix以棉棒去除黏液,丟棄此棉棒。將另一支長棉棒伸入子宮頸之管道,直到整個棉花拭子看不到為止。旋轉棉棒5-10秒鐘,取出棉棒(勿接觸到陰道管壁),斷入採集瓶中。
a) 在發病初期(約五日以內),儘可能於兩個以上不同部位採集檢體。
b) 採檢後以冰浴(4℃運送)方式迅速送至檢驗科;若無法立即送檢時,可將檢體暫置於冰箱冷藏(2-8℃),於採檢後24小時內傳送至病毒血清組處理。
c) 切勿將檢體置於冰箱冷凍層(-20℃或以下)保存,否則病毒不易培養。
d) 欲培養CMV,RSV之檢體須當天送檢,因CMV,RSV不穩定。
e) 病毒抗原檢體:最好採鼻咽抽出液(Nasopharyngeal aspirate)置入採集瓶中送至病毒室。
f) 血清抗體檢體:抽血3-5mL置入生化管中,儘可能取兩次檢體,即發病初期與二至三星期後(恢復期),以便於比較做為診斷。
11. 檢驗科各檢驗項目最低檢體量
11.1 為避免干擾檢驗結果,未達最低檢體量之檢體將予以退件處理。
11.2 各檢驗項目之最低檢體量及標準檢體量,請參照本手冊 四、各組作業規則內容